DIAN FERDINAN T
RRA1C114005
Reaksi Adisi
Reaksi adisi adalah reaksi penggabungan dua atau lebih molekul menjadi sebuah molekul yang lebih besar dengan disertai berkurangnya ikatan rangkap dari salah satu molekul yang bereaksi akibat adanya penggabungan. Biasanya satu molekul yang terlibat mempunyai ikatan rangkap. Reaksi ini hanya terjadi hidrokarbon tak jenuh (alkena dan alkuna). Contoh reaksi adisi adalah reaksi antara etena dengan gas klorin membentuk 1,2-dikloroetana.
Reaksi adisi terjadi pada senyawa yang mempunyai ikatan rangkap dua atau rangkap tiga, senyawa alkena atau senyaw alkuna, termasuk ikatan rangkap karbon dengan atom lain. Dalam reaksi adisi, molekul senyawa yang mempunyai ikatan rangkap menyerap atom atau gugus atom sehingga ikatan rangkap berubah menjadi ikatan tunggal.
Alkena dan alkuna dapat mengalami reaksi adisi dengan hidrogen, halogen maupun asam halida (HX). Untuk alkena atau alkuna, bila jumlah atom H pada kedua atom C ikatan rangkap berbeda, maka arah adisi ditentukan oleh kaidah Markovnikov, yaitu atom H akan terikat pada atom karbon yang lebih banyak atom H-nya (“yang kaya semakin kaya”). (Pada reaksi ini berlaku hukum Markovnikov ”Atom H dari asam halida ditangkap oleh C berikatan rangkap yang mengikat atom H lebih banyak atau gugus alkil yang lebih kecil).
Contoh:
Pada prinsipnya dalam reaksi ini terjadi pemutusan ikatan rangkap dan ikatan yang terputus digantikan dengan mengikat atom atau gugus atom lain. dalam contoh di atas ikatan rangkap dua mengalami pemutusan kemudian digantikan dengan mengikat -H dan -Cl dari HCl. cara pemilihan letak ikatan -H dan -Cl menggunakan aturan Markovnikov yakni "atom H akan terikat pada atom karbon yang lebih banyak H nya". pada contoh di atas atom C di sebelah kiri ikatan rangkap tidak mengikat H sedangkan atom C di sebelah kanan ikatan rangkap mengikat 1 atom H sehingga atom H dari HCl akan diikat oleh atom C di sebelah kanan ikatan rangkap dan Cl dari HCl akan diikat oleh aotm C di sebelah kirinya. aturan ini juga berlaku untuk reaksi adisi dengan senyawa lain selain HCl.
Reaksi adisi terjadi pada senyawa tak jenuh. Molekul tak jenuh dapat menerima tambahan atau gugus dari suatu pereaksi. Dua contoh pereaksi yang mengadisi pada ikatan rangkap adalah brom dan hidrogen. Adisi brom biasanya merupakan reaksi cepat, dan sering dipakai sebagai uji kualitatif untuk mengidentifikasi ikatan rangkap dua atau rangkap tiga. Reaksi adisi secara umum dapat digambarkan sebagai berikut :
1. Adisi Elektrofilik
Reaksi adisi elektrofilik terjadi apabila gugus yang pertama menyerang suatu ikatan rangkap pereaksi elektrofil. Reaksi adisi elektrofilik ditemukan pada senyawa C yang mengandung ikatan rangkap antara dua atom C seperti alkena dan alkuna. Contoh reaksi adisi elektrofilik adalah reaksi antara etena dengan asam klorida menghasilkan etil-klorida.
2. Adisi Nukleofilik
Reaksi adisi nukleofilik terjadi apabila gugus yang pertama kali menyerang suatu ikatan rangkap merupakan pereaksi nukleofil. Reaksi adisi nukleofilik ditemukan pada senyawa C yang mengandung ikatan rangkap antara dua atom C dengan atom lain, seperti senyawa yang mengandung gugus karbonil dan senyawa yang mempunyai gugus sianida. Contoh reaksi adisi nukleofilik adalar reaksi antara dimetil-keton dengan asam sianida menghasilkan 2-siano-2-propanol.
Adisi nukleofilik ini khusus untuk HX terhadap senyawa C = C – Z, dimana Z adalah CHO, COR, COOR, CN, NO2, SO2R, gugus ini mendominasi delokalisasi elektron pada senyawa intermediet.
Reaksi Adisi Alkena oleh Hidrogen
Reaksi adisi oleh hidrogen disebut juga reaksi hidrogenasi. Reaksinya dapat digambarkan sebagai berikut.
Hidorgen mengadisi alkena dengan katalis yang sesuai. Proses ini disebut hidrogenasi.Katalis biasanya berupa serbuk halus logam, seperti nikel, platinum, atau paladium. Logam ini menyerap (adsorb) gas hidrogen pada permukaannya dan mengaktifkan ikatan hidrogen-hidrogen. Kedua atom hidrogen biasanya menhgadisi dari permukaan kartalis kemuka yang sama dari ikatan rangkap. Contohnya, 1,2-dimetilsiklopentana terutama menghasilkan cis 1,2-dimetilsiklopentana
Reaksi Adisi Alkena oleh Halogen
Reaksi adisi oleh halogen disebut sebagai reaksi halogenasi. Jika halogennya berupa klorin (Cl2) disebut klorinasi, jika halogennya bromin (Br,) disebut reaksi brominasi. Reaksinya dapat digambarkan sebagai berikut.
Reaksi brominasi etena:
Reaksi brominasi digunakan untuk membedakan golongan alkena dan alkana. Gas etena jika dilewatkan ke dalam air brom (berwarna cokelat kemerahan), maka akan bereaksi membentuk larutan 1,2-dibromoetana yang tidak berwarna. Alkana tidak mempengaruhi warna air brom ketika senyawa itu dilewatkan ke dalamnya.
Reaksi iodinasi etena:
Reaksi Adisi Alkena oleh Asam Halida
Reaksi adisi oleh asam halida disebut reaksi hidrohalogenasi. Reaksinya dapat digambarkan sebagai berikut.
Berbagai asam mengadisi ikatan rangkap alkena. Ion hidrogen (atau proton) mengadisi satu karbon pembawa ikatan rangkap, dan sisa asamnya akan terhubung dengan atom karbon lainnya. Asam yang mengadisi dengan cara ini ialah halida-halida hidrogen (HF, HCl, HBr, HI) dan asam sulfat (H-OSO3H).
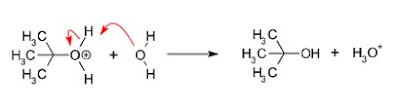
Reaksi Adisi Alkena oleh Air
Reaksi adisi oleh air disebut juga reaksi hidrasi. Selain alkena dan air, dalam reaksi ini juga diperlukan asam (H ,S0,, atau H ,P04) dan katalis. Reaksi hidrasi dapat digambarkan sebagai berikut.
Reaksi adisi alkena banyak digunakan dalam industri pembuatan etanol dari fermentasi glukosa.
Cara menyatakan konformasi dengan proyeksi Newman Perhatikan kembali konformer pada etana :
Cara menyatakan konformasi dengan proyeksi Newman Dua konformer etana yang penting: ‘nyaman’ dan ‘gerhana’
PERMASALAHAN
MENGAPA SENYAWA ALKANA TIDAK BISA MENGALAMI REAKSI ADISI?